半个月前,国家食品药品监督管理局(CFDA)发布关于修订“茵栀黄口服制剂”说明书的公告。公告对茵栀黄口服制剂说明书提出修订要求。具体内容如下:

一、【不良反应】项增加以下内容:
本品有腹泻、呕吐和皮疹等不良反应报告。
二、【注意事项】项增加以下内容:
1.鉴于茵栀黄口服制剂有葡萄糖-6-磷酸脱氢酶(G6PD)缺乏患者发生溶血的个例,目前关联性尚无法确定,有待进一步研究,建议葡萄糖-6-磷酸脱氢酶(G6PD)缺乏者谨慎使用。
2.脾虚大便溏者慎用。
这是继去年八月份,CFDA大范围修订“茵栀黄注射液”说明书后的又一进步。
从给孕妇、新生儿、婴幼儿禁用茵栀黄注射液,到茵栀黄口服制剂说明书的大规模修订,其中必然有着大量的临床不良反应案例换来的结果。
好在,种种迹象预兆着,茵栀黄终将撤出市场。
“茵栀黄”的前世今生
茵栀黄,顾名思义,主要成分为茵陈、栀子、黄芩。是由《伤寒论》里的陈蒿汤演化而来的中成药。
直到今天,它依然在中国被当作治疗新生儿黄疸的“神药”,说它“神”倒不是多有功效,而在于,即使劣迹百出却依然能屹立不倒。
循证医学告诉我们,不轻易使用一个药,也不轻易否定一个药。所以我们不妨来回顾一下茵栀黄的应用发展史。
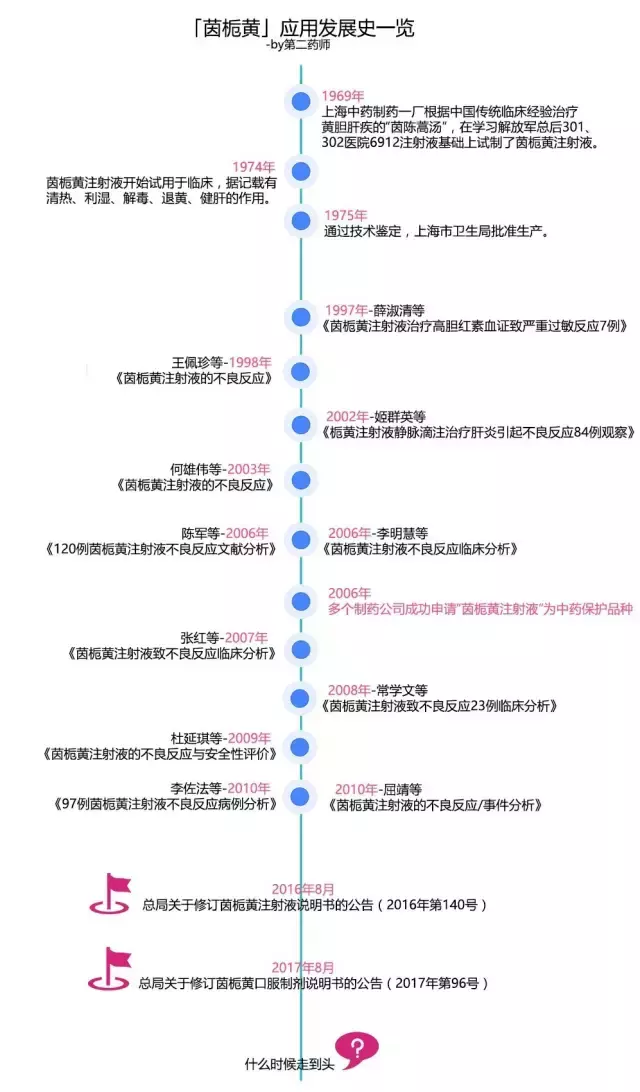
2016年8月,在不良反应不断被报告的情况下,沉寂了将近20年的CFDA开始大刀阔斧修改说明书,并明令禁止将茵栀黄注射液用于孕妇、新生儿、婴幼儿。那时还有人对这项举措不以为然,认为注射液本来副作用就大,口服制剂还是蛮安全的。
这不,时隔一年,CFDA开始对茵栀黄口服制剂出手。

图片来源:emeraldhillspharmacy.com
茵栀黄注射液存在巨大风险
这一年间茵栀黄到底发生了什么,医药行业的明白人或许早有预料。我们不如就事论事,理性的来分析一番。
先来看看去年被CFDA点名批评的茵栀黄注射液。

中药注射液被大规模修改说明书,主要原因不外乎以下四种:
① 质量不稳定:现有的中药注射剂产品绝大多数是提取混合物,并没有分离出能够进行完全定性何定量的产品,这决定了注射剂内在质量的不稳定,导致疗效不稳定并影响安全性。
② 成分复杂:中药注射剂成分复杂,由于其含有蛋白、淀粉、鞣酸、色素、树脂、挥发油等致敏成分,一旦入血,刺激机体产生抗体或致敏淋巴细胞,当再次接触该抗原即发生过敏反应。
③ 过敏原突出:中药注射剂的多种成分在配制过程中和放置过程中的变化可引起过敏反应,制剂中含有的杂质作为致敏原也可引起过敏反应,或多种组分在一起发生复杂的化学反应引起过敏反应。
④ 临床认识不足:部分临床医生认为中药毒副作用低,往往用药剂量偏大,用药时间过长,而引起药物的蓄积作用发生药物不良反应(ADR)。
这四个方面,是茵栀黄注射液不良反应的一个缩影,也意味着将这样的东西注射到血管里,即使是成年人也存在巨大风险。
图片来源:bu-shen.com
口服制剂也好不到哪里去
作为“同父异母”兄弟的茵栀黄口服制剂也好不到哪里去。
首先,茵栀黄对新生儿黄疸的退黄原理,主要是起刺激性泻药的作用,来促进孩子排便。
新生儿本来胃容量就小,胃肠道功能发育不完善,通过这些不明中成药成分的刺激,发生腹泻的风险极高。(关于黄疸的正确处理,可以参考文章:《黄疸九问——新生儿高胆红素血症您需要了解的方方面面》)
其次,茵栀黄注射液的履历也提醒我们,其成分有导致皮疹、过敏的风险。
所以CFDA要求药品厂家将口服制剂的不良反应增加“腹泻、呕吐、皮疹”的事实也反过来说明,在不良反应方面,注射液和口服制剂有某些共同点,其使用安全性依然成疑。
最后,我们国家2001年才正式开通药物不良反应(ADR)监测信息网络系统。
其覆盖的面,以及医务人员和患者对ADR上报的意识还不足,这导致我们对日常使用的药物的认识远远不够。

要改善这一现状,需要大家共同努力。
医生要自觉停止使用高安全风险的药品,患者也有权拒绝使用高安全风险的药品,对于出现的不良反应,双方都要自觉上报医院药剂科。唯有这样,推动安全用药才不至于被人说成是无理取闹。
作者介绍

版权声明:本站所有资源均来源于互联网或网友投稿,如有侵犯您的著作权或隐私,请联系QQ:1765130767。我们将第一时间为您处理!

